Análisis del Perfil de Expresión de Proteínas del Organismo halotolerante Tistlia consotensis Bajo Diferentes Condiciones de salinidad
Carolina Rubiano-Labrador 1 ; Sandra Baena 2 *
1 Microbióloga industrial. Doctora en Ciencias Biológicas, 2 Bióloga, Maestría en Saneamiento y Desarrollo Ambiental, Doctora en Ciencias.
1,2 Unidad de Saneamiento y Biotecnología Ambiental - Departamento de Biología - Facultad de Ciencias - Universidad Javeriana, POB 56710, Bogotá DC, Colombia
1 baena@javeriana.edu.co , 2 drubiano@unitecnlogica.edu.co
Resumen
En su hábitat natural Tistlia consotensis , bacterias UNA halotolerante el aislada de la ONU manantial salino colombiano, this Expuesta una Variaciones continuas en la osmolaridad necesitando por lo Tanto Una Respuesta Efectiva Frente a: cambios en la salinidad. Para determinar S. el Perfil de Expresión de Proteínas de T. consotensis bajo Diferentes salinidades (0, 5 y 40 g · l -1 NaCl) se utilizó la técnica de electroforesis bidimensional (2-DE) para · analizar el Cambio de Expresión de Sus Proteínas en Respuesta al estrés osmótico. De Acuerdo a los Resultados obtenidos, se identificaron 56 manchas proteicas con Cambios significativos de Expresión. En ausencia de NaCl, 22 manchas se sobre-expresaron y 5 se sub-expresaron MIENTRAS Que un 40 g · l -1 de NaCl Seis manchas se sub-expresaron. El análisis de los Perfiles de Expresión de Proteínas de T. consotensis permitio Determinar Que esta bacteria halotolerante Responde a los Cambios de salinidad del medio Perfil Expresando ONU diferencial de Proteínas, Donde un alcalde salinidad Disminuye El Número e Intensidad de Proteínas expresadas. : Además, se detectaron Proteínas Que probablemente confieren una T. consotensis la Capacidad de Adaptación a las Condiciones cambiantes de salinidad.
Palabras claves: halotolerante, estrés osmótico, electroforesis bidimensional, proteoma, Expresión de Proteínas, Tistlia consotensis
Introducción
La mayor parte de la biosfera es salina. El Agua de los Océanos y mares Cubre ONU Alto Porcentaje de la superficie terrestre, y approximately Contiene de 35 a 40 gramos de ventas disueltas por litro. En las Zonas continentales se encuentran manantiales o brotes de aguas salinas con contenido de Sales Entre 20 y 35 g · l -1 (Andrei et al ,. 2012). En Colombia, abundan los manantiales salinos y ESTÁN Caracterizados por aflorar sobre o cerca de Trazos de Fallas Geológicas, una en Pocos metros de drenajes mayores (Cortes y Cardona 2006), ya lo Largo de las Tres cordilleras, los situados à grandes Distancias de las costas. Estós manantiales difieren en su Composición química SEGÚN La Interacción del agua con la roca y La Composición de la Misma; Y algunos adj pueden Tener altos Contenidos de bicarbonatos, cloruros, sulfatos o ( Díaz-Cárdenas, 2011 ). En la región suroccidental de la Cordillera Central en Colombia, ESTOS manantiales hijo considerados fuente de Recursos Minerales (es concentrations explotables) y de recursos hídricos Por Su Estrecha Relación con las Aguas Subterráneas ( Alfaro, Aguirre, y Jaramillo, 2002 ).
Dentro de los manantiales salinos de la cordillera central se Destaca El Manantial denominado Salado de Consota, utilizado en Épocas precolombinas párrafo explotación de sal, abandonado posteriormente, y re-Descubierto en el año 2003, y declarado Sitio de Interés Arqueológico ( Tistl, 2004 ) . Este manantial UBICADO EN EL Departamento de Risaralda (04 ° 47' 18,9" N, 75 ° 41' 35,0" W; 1,390 msnm), Presenta Una Temperatura Promedio de 21 ° C, pH Entre 6,1 y 7,4, y Alta Concentración de Cl - (14,500 mg · l -1 ), Na + (6500 mg · l -1 ), Ca 2+ (3000 mg · l -1 ) y conductividad Eléctrica de ~ 35000 mS · cm -1 . Previos estudios de diversidad microbiana en el Salado de Consota revelaron Una Diversidad taxonómica bacteriana sin los antes descrita, evidenciada por el alto Número de Secuencias del gen 16S rRNA con Menos de 97% de similitud con Secuencias de Organismos previamente Cultivados Y POR EL Aislamiento e Identificación de Potenciales Nuevas Especies (Díaz-Cárdenas, 2011). Entre estas, Aparece la cepa USBA 355, identificada Como un nuevo género bacteriano halotolerante de la clase alfa-proteobacterias, familia Rhodospirillaceae, fijador de Nitrógeno de vida libre, denominado Tistlia, con sueltas Una especie identificada Hasta el Momento, T. consotensis (Díaz -Cárdenas et al., 2010). Este Organismo es capaz de acumular 3-polihidroxialcanoatos (PHAs) y metabolitos Secundarios con Actividad biológica potencial ( Díaz-Cárdenas, 2011 ). La Mayoría de los GENEROS DE this familia de Como Thalassobaculum ( Zhang, Hwang, y Cho, 2008 ), Nisea ( Urios, Michotey, Intertaglia, Lesongeur, y Lebaron, 2008 ), Thalassospira (Kodama et al., 2008), Rhodospira, Roseospira, Rhodovibrio, Rhodospirillum ( Imhoff, Petri, y Suling, 1998 ) , Marispirillum ( Lai, Yuan, Gu, y Shao, 2009 ), Oceanibaculum ( Lai, Yuan, Wu, y Shao, 2009 ), Tistrella (Shi et al., 2002) y Pelagibius ( Choi, Hwang, y Cho, 2009 ), Habitan en ambientes marinos, indicando Que la adaptation un Condiciones salinas es una Característica Común de los Miembros de this familia.
Durante monitoreos sucesivos del contenido de Sales en EL Salado de Consota Entre 2005 y 2009 se observaron Valores oscilantes de cloruros (10646 un 15,100 mg · l -1 ), eléctrica conductividad (29300 a 35150 mu S · cm -1 ) y Sólidos disueltos Totales ( 24185 un 41,859 mg · l -1 ) Relacionados Posiblemente con el Régimen de LLUVIAS y de sequía como lo Reporta Díaz-Cárdenas (2011). Si bien los Organismos catalogados Como halófilos requieren concentrations Entre 1 y 325 g · l -1 NaCl para Crecer y Conservar la integridad de Sus Células ( Ventosa, Mellado, Sánchez-Porro, y Márquez, 2008 ), las Comunidades bacterianas halófilas o halotolerantes de ESTOS ESTÁN manantiales expuestas un continuo Cambios en la Concentración de las ventas. Este Hecho sugiere la Presencia de Mecanismos de Adaptación y / o tolerancia de un Estas Condiciones cambiantes. Las respuestas bacterianas al estrés salino se originan por la Expresión Regulada de genes Que Alteran Diferentes Procesos Celulares Como la división celular, la Composición de la membrana celular, los Mecanismos de transporte, Entre Otros, Que actuan para desencadenar la Tolerancia a la Condición de estrés . Como los Procesos de Adaptación involucran habitualmente ONU Número Importante de Componentes proteínicos (Ambily-Nath y Loka-Bharathi 2011) (Renzone et al., 2005) (Renzone et al., 2005) (Renzone et al., 200 5) (Renzone et al., 200 5), La Expresión de Proteínas de Organismos sometidos a estrés Salino Es un Mecanismo adicional Los de Analisis de La Respuesta Celular unos Estas condiciones.
T consotensis Crece En un Rango de salinidad Entre 0 y 40 g · 1 -1 NaCl, y Alcanza ONU Crecimiento Óptimo en Presencia de 5 g · 1 -1 NaCl ( C. Díaz-Cárdenas, Patel, y Baena, 2010 ). El Rango Amplio de salinidad tolerado permite suponer Que Frente a las Condiciones cambiantes de salinidad Este Organismo Responde Expresando diferencialmente Proteínas Contra el estrés Frente a altas salinidades o implicadas en Mecanismos de Transporte de solutos compatibles, los Cuales pueden Ser acumulados en la célula en altas concentrations proporcionando el equilibrio osmótico pecado Alterar las FUNCIONES ESENCIALES Celulares. Dentro de los solutos Más ampliamente utilizados se encuentran la glicina betaína, la ectoína, la prolina y el glutamato (Kempf y Bremer 1998; Saum y Muller 2008;. Vargas et al 2008). Con El Fin de identificar patrones diferenciales de Expresión de Proteínas Frente a la salinidad del medio de cultivo y con ola, Comprender La Respuesta de T. consotensis un oscilantes Condiciones de salinidad en su hábitat natural, En Este estudio se evaluó el Perfil de Expresión de Proteínas intracelulares en respuesta a: cambios en la Concentración de NaCl (0, 5 y 40 g · 1 -1 ), ya Que Estas Tienen una Función clave en Mecanismos de osmoregulación Porque ESTÁN implicadas en Procesos de Como transducción de señales, transporte un Través de membrana Y Síntesis de solutos compatibles. Para Este aleta, se utilizó la técnica de electroforesis bidimensional (2-DE), Que permite la Visualizacion y Separación de Proteínas en Función de Sus propiedades eléctricas (punto isoeléctrico, pI), SEGUIDA De Una Separación electroforética en Función de su Tamaño o peso molecular. This tool permite analizar v Los Cambios de Intensidad y volumen de las manchas proteicas detectadas en las salinidades evaluadas para identificar Aquellas Que Presentan: cambios significativos en su Expresión en Respuesta a los Cambios de salinidad en el medio.
Materiales y Métodos
Microorganismo de estudio y Condiciones de cultivo
T consotensis cepa USBA 355 se cultivo en medio básico de ventas (MB), Que contenia (1 -1 ): NH 4 Cl 1 g, K 2 HPO 4 0,3 g, KH 2 PO 4 0,3 g, MgCl 2 . 6H 2 O 3 g, CaCl 2 . 2H 2 O 0,1 g, KCl 0,1 g y 10 ml de Solución de Elementos Traza SL-10 ( Widdel, Kohring, y Mayer, 1983 ), suplementado con D- glucosa (Sigma) 20 mM (Concentración final), Como Fuente de Carbono, y extracto de levadura 2 g · 1 -1 (Sigma) ( C. Díaz-Cárdenas et al. , 2010 ). El pH inicial del medio se ajustó a 6,7 con NaOH 5N. Se Realizo la estandarización de la Concentración del inóculo de T. consotensis , relacionando los Valores de densidad óptica (DO) espectrofotométricamente Medida un 580 nm con el peso seco de la biomasa (μg Células m1 -1 ), En Una curva de peso seco , Con el fin de establecer la Concentración celular de los inóculos Usados Durante Este estudio. Para determinar S. el efecto del NaCl Sobre el Crecimiento de T. consotensis , se cultivo el Organismo en medio MB con Diferentes concentrations de NaCl: 0, 5, 20, 30 y 40 g · 1 -1 . Se Realizo el Seguimiento del Crecimiento microbiano Durante 24 horas con Lecturas CADA 2 horas, por duplicado, de la DO una nm 580 (HACH DR 5000). Los Datos de DO se transformaron un logaritmo natural (ln) para Realizar una gráfica LN vs. Tiempo, A partir de this gráfica se Realizo Una regresión lineal y se CALCULO La Pendiente Que corresponde a la Velocidad Específica de Crecimiento (μ esp ).
Para Realizar el análisis del Perfil de Expresión de Proteínas de T. consotensis en respuesta un Diferentes salinidades, se evaluaron tres Condiciones de cultivo Que contenían 0, 5 y 40 g · 1 -1 de NaCl, Que corresponden a las concentrations Mínima Óptima y Máxima de Crecimiento, respectivamente. El Porcentaje de inóculo utilizado FUE de 10% (v / v) (~ 480 g Células · ml -1 ) y todos los Cultivos se incubaron en 600 ml de medio MB a 30 ° C, el pecado Agitación y en oscuridad Durante 36 horas.
Extracción de Proteínas intracelulares
T consotensis se Cultivo Dos Veces sucesivas Bajo las Mismas conditions EXPERIMENTALES (Diferentes concentrations de NaCl) y por duplicado. La Extracción de Proteínas se Realizo En Cada uno de los Duplicados párrafo Cada evaluada salinidad, para su posterior análisis electroforético bidimensional. Las Muestras de ESTOS Cultivos se recolectaron en la Mitad de la fase exponencial (DO 580 0,4-0,5) Mediante centrifugación a 4000 g por 10 min a 4 ° C. Los precipitados obtenidos se lavaron Dos Veces con el Tampón Tris-HCl 50 mM (pH 7,4) y se re-suspendieron en 300 l de tampon de lisis (urea (Sigma) 9,5 M, tiourea (Sigma) 2 M, Triton X-100 (Sigma) (v / v) 1%, 3 - [(3-colamidopropil) dimetilamonio] -1propano sulfonato (CHAPS) (Merck) (p / v) 4%, Lisozima (Sigma) 200 mg · ml -1 y ditiotreitol (DTT) (Sigma) 100 mM) y se incubaron en hielo por 30 min. La Extracción de Proteínas intracelulares se Realizo Siguiendo el protocolo sanitario descrito por Feng et al. (2007), consistió Que, Brevemente, en La Ruptura Celular Mediante sonicación (Ciclos: 15, amplitud: 19%, Tiempo total: 1 minuto, pulsos en : 4 Segundos Y pulsos off : 56 de descanso) en hielo y posterior centrifugación una 12,000 rpm por 15 min, los sobrenadantes obtenidos se almacenaron a -80 ° C Hasta su evaluation. La limpieza de Proteínas se Realizo utilizando el kit de ReadyPrep 2-D Cleanup (Bio-Rad Laboratories, Hercules, CA, EE.UU.) SIGUIENDO las Indicaciones del Fabricante, Que permite ELIMINAR contaminantes Como ventas, Detergentes iónicos, lípidos y Ácidos nucléicos Que pudieran interferir en El Proceso de isoelectroenfoque (IEF por Sus siglas en inglés de primera dimensión isoeléctrico de enfoque ). La Concentración Total de Proteínas se determinó utilizando la técnica de Bradford ( Bradford, 1976 ) Usando albúmina de suero bovino (BSA) Estándar de Como.
Electroforesis bidimensional (2-DE)
Las Fracciones proteicas obtenidas se evaluaron Mediante electroforesis unidimensional en las Condiciones desnaturalizantes, producidas por la Presencia de SDS y TDT, SEGUIDA de electroforesis bidimensional (2-DE).
Las Proteínas intracelulares de T. consotensis (200 μg · μl -1 ) extraídas En cada Condición de salinidad se rehidrataron en 150 μl de tampon de rehidratación (urea 7 M, tiourea 2 M, CHAPS al 2% (p / v), DTT 50 mM, anfolitos al 0,5% (v / v) y azul de bromofenol 0,002% (p / v)) por 12 horas a 20 ° C. El isoelectroenfoque (IEF) se Realizo en geles de gradientes inmovilizado con tiras IPG ( gradiente de pH inmovilizado -IPG- ) de 7 cm de Longitud Con Un Rango de pH de 3 - 10NL ( No Lineal ) y 3 - 6NL (Bio-Rad) Usando El Sistema Ettan IPGphor II (Amersham Biosciences) Durante 2 ha 300 V Seguido por 1 h 15 min a 1000 V, 2 ha 5.000 V y 1 h 10 min a 5000 V. posterior al isoelectroenfoque, las tiras IPG se equilibraron Dos Veces por 15 Minutos Siguiendo el Protocolo descrito por Cho et al. (2003) Las tiras IPG se depositaron Sobre geles de SDS-PAGE al 12% (p / v) (8,3 x 7,3 cm) y se fijaron con Una Solución de agarosa al 0,5% (p / v) Que contenia azul de bromofenol 0,002% (v / p). La Separación en Segunda dimensión se Realizo Usando El Sistema Mini-PROTEAN Tetra Cell (Bio-Rad) a 100 V Usando geles SDS-PAGE al 12% (p / v). Se utilizó la ONU marcador de peso molecular de 200 kDa (BioRad).
Tinción de los Geles bidimensionales
Las Proteínas se visualizaron utilizando la técnica de tinción azul de plata ( Candiano et al. , 2004 ) Que contenia Azul de Coomassie G-250 (Sigma) 0,12% (p / v), sulfato de amonio al 10% (p / v) , ácido fosfórico 10% (p / v) y metanol 20%. Los geles se sumergieron Durante Toda una noche en La Solución de azul de plata y posteriormente los geles se decoloraron con Agua destilada de Durante 6 horas Hasta ELIMINAR EL Completamente Exceso de colorante. Las imagenes de los geles se capturaron Con Un Sistema LabScan (Amersham) con Una Resolución de 300 dpi.
Análisis de los Geles bidimensionales
El análisis de las Imágenes SE LLEVO un cabo con la ayuda de la plataforma informática PDQuest v.8 (Bio-Rad). Las Imágenes se filtraron y Las Diferencias de tinción se normalizaron Mediante El Método denominado Cantidad total de manchas proteicas de Validas , el cual sea brecha Cada mancha proteica Entre la Cantidad Total de manchas proteicas Presentes en el gel. Se determinó El Numero de manchas proteicas Y SU INTENSIDAD En Los Geles obtenidos, teniendo en Cuenta los Duplicados Condición párrafo Cada. La Intensidad de Cada mancha proteica corresponde una ANU Medida indirecta de su concentration, sea cual sea la varia dependiendo del Nivel de Expresión En Cada salinidad evaluada. La comparacion de la Intensidad de Cada mancha proteica en las tres salinidades evaluadas SE LLEVO un Cabo Usando la prueba estadística t -Estudiante (p <0,05), y Solo se tuvieron en Cuenta los Valores de Intensidad de las manchas proteicas Que presentaran differences significativas estadísticamente. El mapa proteómico obtenido un 5 g1-1 NaCl se utilizó Como Condición de control de para Realizar el análisis de la Presencia de manchas diferenciales (sobreexpresadas o subexpresadas) un 0 y 40 g1 -1 NaCl.
Resultados
Patrón de Crecimiento de T. consotensis en Diferentes concentrations de NaCl
La curva de peso seco permitio determinar S. Que en la Mitad de la fase exponencial (DO 580 nm Entre 0,4-0,5) la Concentración de Células de T. consotensis corresponde a ~ 480 g Células · ml -1 . Este valor de DO se Tuvo en Cuenta para establecer la Concentración celular de los inóculos Usados Durante Este estudio.
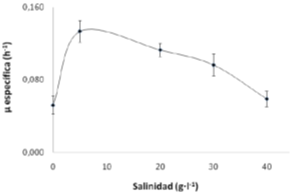
El efecto de la Concentración de NaCl Sobre el Crecimiento de T. consotensis se Observa en la Figura 1. T. consotensis Crece En un Rango de salinidad Entre 0 y 40 g1-1 , y Presenta Una Concentración Óptima de NaCl a 5 g1-1 , Donde se obtuvó la mayor Velocidad de Crecimiento (μ esp de 0.125 h -1 ), MIENTRAS Que un 0 y 40 g1 -1 se obtuvó Menos de la Mitad de Este valor (μ esp de 0045 h - 1 y 0.053 h -1 párr 0 Y 40 g1 -1 NaCl, respectivamente), a la Mitad de la fase exponencial.
Figura 1. Velocidad Específica de Crecimiento (μ esp ) de T. consotensis cultivada en Diferentes salinidades: 0, 5, 20, 30 y 40 g1-1 NaCl. Cada punto Representa el valor medio de dos réplicas.
Efecto de las Diferentes Condiciones de salinidad Sobre el proteoma de T. consotensis
En Este estudio se utilizó la técnica de electroforesis bidimensional para identificar los Cambios Que ocurren en el proteoma de T. consotensis en respuesta a: cambios en la Concentración externa de NaCl. El análisis inicial de las Proteínas intracelulares de T. consotensis Sobre los geles bidimensionales con tiras IPG de Amplio Rango de pH (3-10) mostraron Que la Mayoría de las manchas proteicas se agrupó En un Rango de pH Entre 4,0 y 7, 0, Más información es disponible en Supt. 1. Por lo Tanto, Los Siguientes Experimentos sí Llevaron un cabo utilizando tiras IPG ONU de la estafa Rango de pH estrecho (3-6) para Obtener Una mejor visibilidad y Resolución.
Los mapas proteómicos de T. consotensis obtenidos en las tres salinidades evaluadas se muestran en la Figura 2. de Se identificaron 100 manchas proteicas Entre Las Tres salinidades, las Cuales se distribuyeron En un Rango de masa atómica de 16 a 150 kDa y Un Punto isoeléctrico ( pI) Entre 3,5 y 5,8, Y solo una mancha proteica, detectada ES Las Tres Condiciones, presento ONU pI de 3,5 (Supt. 2).
Figura. 2. Separación de las Proteínas intracelulares de T. consotensis obtenidas por electroforesis bidimensional. a. Mapa proteómico de las Proteínas extraídas un 0 g1-1 NaCl. b. Mapa proteómico de las Proteínas extraídas a 5 g1-1 NaCl. c. Mapa proteómico de las Proteínas extraídas a 40 g1-1 NaCl. La primera dimensión se Realizo en tiras IPG pH 3-6NL, 7 cm. La Segunda dimensión se Realizo Usando El Sistema Mini-Protean Tetra celular con geles de poliacrilamida-SDS al 12%. Tinción con azul de plata . La Concentración de la protein adicionada A Cada gel FUE de 200 μg.
La Figura 3 Muestra Una Representación de la ONU diagrama de Venn para comparar El Número de manchas proteicas identificadas En Cada salinidad. Se identificaron 69, 77 y 18 manchas proteicas un 0, 5 y 40 g1-1 de salinidad, respectivamente, y 17 manchas proteicas were comunes en Las Tres salinidades, las Cuales representan ~ 17% de las Proteínas identificadas.
Figura 3. Diagrama de Venn Mostrando El Número de manchas proteicas detectadas en T. consotensis en Las Tres salinidades evaluadas.
La Distribución de las manchas proteicas con Cambios significativos en su Nivel de Expresión en las Diferentes salinidades evaluadas SE Encuentra en la Tabla 1. En total de se identificaron 56 manchas proteicas con Cambios significativos en su Expresión ( p <0,05), las Cuales presentaron ONU pI Entre 4,5 y 5,8. En ausencia de NaCl, 50 manchas presentaron Cambios significativos en su Nivel de Expresión ( p <0,05) en comparacion con la salinidad Óptima de Crecimiento de T. consotensis (5 g · l -1 NaCl). El Perfil de Proteínas Que presentaron Cambios en su Nivel de Expresión un 0 g1-1 NaCl se Muestra en la Figura 4. A partir del análisis de los geles bidimensionales se detectaron 22 manchas proteicas sobre-expresadas un 0 g1-1 NaCl y 5 sub-expresadas. : Además, 23 manchas proteicas were inducidas Solo en ausencia de NaCl MIENTRAS Que 31 Manchas proteicas no se detectaron en this Condición.
Tabla 1. Distribución de las manchas proteicas Que presentaron Cambios significativos de Expresión en las salinidades Diferentes evaluadas
Figura. 4. Perfil proteómico de T. consotensis , cultivada en Presencia de 0 g1-1 NaCl. 50 manchas proteicas presentaron Cambios significativos de Expresión en ausencia de NaCl ( p <0,05) . Imágenes ampliadas de ALGUNAS manchas proteicas sobre- y sub expresadas mostradas hijo, en comparacion con la de control de salinidad (5 g1-1 NaCl). In La Parte inferiores SE Encuentra El Gráfico De La Intensidad total de manchas de las proteicas sobre- Y sub-expresadas un 0 g1-1 . Cada barra Representa el valor medio de dos réplicas (geles).
En la Máxima salinidad tolerada por T. consotensis , 40 g1-1 NaCl, no se DETECTO la sobre-Expresión o inducción de Ninguna mancha proteica ( p > 0,05), MIENTRAS Que Seis manchas proteicas (5, 8, 13 , 15, 19 y 29) (Figura 5) presentaron una disminución Significativa ( p <0,05) en su Nivel de Expresión MIENTRAS Que 82 Manchas proteicas desaparecieron un 40 g11 NaCl. Por Otro Lado, LA EXPRESION de Cuatro Manchas proteicas (5, 13, 15 y 29) disminuyó significativamente ( p <0,05) un 0 y 40 g1-1 de NaCl, ES comparacion Con La salinidad Optima MIENTRAS Que 30 manchas proteicas no se detectaron en la salinidad Mínima y Máxima evaluada,
Figura. 5. Perfil proteómico de T. consotensis , cultivada en Presencia de 40 g1-1 NaCl. 6 manchas proteicas presentaron Cambios significativos de Expresión en Presencia de 40 g1-1 NaCl ( p <0,05) . Imágenes ampliadas de ALGUNAS manchas proteicas mostradas hijo sub-expresadas, en comparacion con la de control de salinidad (5 g1-1 NaCl). In La Parte inferiores SE Encuentra El Gráfico De La Intensidad totales de Las Manchas proteicas sub-expresadas a 40 g1-1 . Cada barra Representa el valor medio de dos réplicas (geles).
Discusión
Las Capacidades adaptativas de un son Organismo Bajo Condiciones Ambientales cambiantes cruciales para su Supervivencia. Para adaptarse a Diferentes Condiciones Ambientales Los Organismos Deben Ser CAPACES de inducir y mantener su metabolismo en el nuevo ambiente. El Método Más Común para Sobrevivir bajo estrés ambiental es change metabolismo o la Estructura Celular Mediante la inducción de Nuevas Proteínas párrafo respondedor INMEDIATAMENTE a Las Condiciones Ambientales cambiantes o Mediante la Eliminación de ALGUNAS Proteínas ya existentes en la célula ( Ceylan, de Yilan, Akbulut, Poli, y Kazan, 2012 ). Los Mecanismos de Adaptación a las Condiciones de estrés osmótico Han Sido extensivamente estudiados en: organismos halófilos Como Halobacterium salinarium ( Leuco, Raftery, Burns, Walter, y Neilan, 2009 ), salexigens Chromobacter ( Oren, Larimer, Richardson, Lapidus, y Csonka, 2005 ) y Halobacillus halophilus (Saum y Muller 2007). Sin embargo, los estudios enfocados en La Respuesta adaptativa de microorganismos halotolerantes limitados hijo, Solo EXISTEN ALGUNOS Reportes ES Bacterias patógenas halotolerantes Como E. coli (Weber & Jung 2002) , Bacillus cereus ( den Besten, el mol, Moezelaar, Zwietering, y Abi, 2009 ) y Listeria monocytogenes ( Duché, Trémoulet, Glaser, y Labadie, 2002 ). En Este estudio, se evaluó el PERFIL de Expresión de Proteínas De La bacteria halotolerante Tistlia consotensis , el aislada de la ONU manantial salino terrestre.
Patrón de Crecimiento de T. consotensis en Diferentes concentrations de NaCl
El análisis del efecto de la Concentración de NaCl Sobre el Crecimiento de T. consotensis permitio determinar S. Que su salinidad Óptima de Crecimiento, en las Condiciones de laboratorio, es 5 g · l -1 , es Cual La inferior a la salinidad Que Registra el manantial salino Salado Consota, 45 g · l -1 , Lo Que Demuestra la Capacidad of this bacterias para adaptarse a las Constantes fluctuaciones de salinidad de su hábitat natural. El análisis del efecto de la Concentración de NaCl Sobre el Crecimiento de T. consotensis mostro Una disminución Significativa de la Velocidad de Crecimiento de T. consotensis un 0 y 40 g · l -1 NaCl, la Cual this probablemente Relacionada con su Respuesta frente una Cambios en la salinidad en el medio. Saum & Müller (2008b) sugieren Que El Proceso Complejo de Producción de osmolitos Necesarios para Alcanzar el equilibrio osmótico PUEDE Generar Una disminución de la Velocidad de Crecimiento y Un Incremento de la fase de Adaptación, lo Cual podria explicar el Crecimiento Observado en T. consotensis eN LAS DIFERENTES salinidades.
Efecto de las Diferentes Condiciones de salinidad Sobre el proteoma de T. consotensis
El Perfil de Expresión de Proteínas de T. consontesis un 0, 5 y 40 g · l -1 de salinidad mostro Una Distribución de Sus Proteínas un Debajo de la ONU pH por 7,0, indicando la Tendencia ácida de su proteoma. Estos resultados coinciden con lo reportado microorganismos halófilos párr Como Halobacterium NRC-1 ( Shukla, 2006 ), Halomonas sp. AAD12 ( Ceylan et al., 2012 ), salexigens Chromohalobacter ( Oren et al., 2005 ) y Salinibacter rubi (Oren 2013), Donde Predomina la naturaleza ácida En sus Proteínas. Este Carácter ácido PUEDE Estar relacionado con la ONU Aumento de residuos de carga negativa (Asp y Glu) en la superficie de las Proteínas, Principalmente periplasmáticas, Que Conduce A la Organización de Una Capa de hidratación de los Iones de Sal En La superficie de las Mismas ya la Formación de puentes de sal con Residuos Básicos estrategicamente posicionados, lo Cual proporciona un alcalde Estabilidad Las Proteínas en Presencia de altas concentrations de sal ( Capes, DasSarma, y DasSarma, 2012 ).
El Perfil de Expresión de Proteínas de T. consotensis Observado en las salinidades Diferentes evaluadas demostro Que la Concentración de NaCl del medio Conduce un Una reprogramación sustancial de su proteoma, ya Que 56 de la 100 manchas proteicas detectadas presentaron Cambios significativos en su Expresión. Previos estudios de han demostrado Una Variación de la Expresión de Proteínas del 10-30% en Halobacillus dabanensis ( Feng, Yang, Lu, y Yang, 2007 ), Halomonas sp. AAD12 ( Ceylan et al., 2012 ) Y Listeria monocytogenes ( Duché et al., 2002 ), en respuesta a: cambios en la Concentración de NaCl. Estos resultados contrastan con Nuestros Resultados sugiriendo Que Cada salinidad Requiere Un gran Número de Proteínas especializadas.
La Mayoría de las manchas proteicas con: cambios significativos en su Expresión presento Una disminución de su Expresión Con El Aumento de la salinidad en el medio, indicando Que la Expresión de Proteínas en T. consotensis es Afectada por la Presencia de altas concentrations de NaCl. Este resultado m coinciden con los estudios proteómicos reportados párrafo B. subtilis ( Höper, Bernhardt, y Hecker, 2006 ) y La cianobacterias Euhalothece sp. BAA001 ( Pandhal, Snijders, Wright, y Biggs, 2008 ), Donde se observó Que la Síntesis de Proteínas del metabolismo central de disminuyó en respuesta al Aumento de la Concentración externa de sal, lo Cual se debe probablemente una cola en respuesta a estrés hiper- osmótico Ocurre Una sub-Regulación de genes housekeeping Que no hijo Necesarios para la Supervivencia, MIENTRAS SE Activan otros Cuya Función podria Estar Relacionada con la Protección de la célula (Leuco et al., 2009).
En ausencia de NaCl, se detectaron 22 manchas proteicas sobre-expresadas Que podrian Tener Una Función Importante en La Respuesta adaptativa de T. consotensis Frente a Una disminución de salinidad del medio. La adaptation un estrés hipo-osmótico Requiere Una Rápida Respuesta y Una Efectiva Protección, en la cual sea generalmente ESTÁN involucradas Proteínas estrés contraindicaciones generales, ya Que la Mayoría de las Proteínas Puede Ser parcialmente desnaturalizada Bajo Una dilución de Iones en el medio exterior DEBIDO a la entrada de agua a la célula (Ambily Nath y Loka Bharathi, 2011). Todas las Proteínas con Una Respuesta transitoria típica Despues De Una disminución repentina de la salinidad del medio hijo consideradas Proteínas de estrés en general de 98, 85, 79, 70, 60, 46 y 21 kDa ( Mojica, Cisneros, Ferrer, Rodríguez-Valera, y Juez, 1997 ). La sobre-Expresión, en respuesta un choque hipo-osmótico, de Proteinas estrés contraindicaciones Entre molecular general con masa 90 a 40 kDa ha Sido reportada en Halomonas elongata (42, 60 y 72 kDa) ( Mojica et al., 1997 ), Haloferax volcanii (45, 85, 70 y 79 kDa) ( Daniels, McKee, y Doolittle, 1984 ) y Haloarcula marismortuai (Gupta y Singh 1992) (70 kDa). En Este estudio se identificó la Expresión sobre-de manchas proteicas de 60 (mancha No. 67), 70 (manchas # 63 y 80) y 85 kDa (mancha No. 16) CUANDO T. consotensis se cultivo en ausencia de NaCl, Las Cuales podrian Estar relacionadas con Proteínas estrés contraindicaciones general. Se Requiere de Futuros estudios para determinar S. la Función Que Tienen Estas manchas proteicas en La Respuesta celular de T. consotensis Frente a Una disminución de salinidad externa.
Por Otro Lado, las 31 manchas proteicas Que desaparecieron En Esta Condición probablemente ningún hijo requeridas para la Supervivencia de T. consotensis en respuesta una ANU Condición hipo-osmótica en el medio.
El Estudio de la Alteración transcripcional de E. coli en respuesta a estrés osmótico hiper-Realizado por Weber & Jung (2002) reporto Que la sub-Expresión de genes Que codifican para las subunidades Componentes de ribosomales 50S Y 30S, y Para Proteínas involucradas en rutas del metabolismo central de biosíntesis y de Aminoácidos podria Estar Asociada con la disminución de la tasa de Crecimiento Bajo Condiciones de estrés hiper-osmótico. Este argumento podria explicar el patrón de Expresión de T. consotensis un 40 g · l -1 NaCl de salinidad, Donde se observó ONU Mayor NUMERO de manchas proteicas sub-expresadas ES comparacion estafadores las sobre-expresadas (6 vs . 0). Por Otro Lado, las manchas proteicas Que presentaron Una Tendencia de disminución o Desaparición de su Expresión en la salinidad minima (0 g · l -1 ) y maxima (40 g · l -1 ) tolerada por T. consotensis , probablemente hijo expresadas por bacterias ESTA Condiciones optimas de salinidad Pero su Expresión es Afectada bajo estrés osmótico, indicando Que la Expresión de Estas manchas proteicas no constituyen ONU Mecanismo de omoadaptación.
Conclusiones
Este estudio repre El Primer Reporte del Análisis del proteoma intracelulares De La bacteria T. consotensis cepa USBA 355, AISLADA del Manantial Salado de Consota . El análisis de la Expresión de Proteínas de T. consotensis en respuesta a: cambios en la Concentración de sal en el medio permitio determinar S. Que una Una alta salinidad (40 g · l -1 NaCl), se Observa ONU Cambio Más drástico en el Perfil de Expresión, Donde Las Manchas proteicas detectadas disminuyeron significativamente su Expresión, MIENTRAS Que en ausencia de la sal del La Mayoría de manchas detectadas Aumentó su Expresión en comparacion con las de otras DOS salinidades. : Además, los Resultados sugieren Que T. consotensis Expresa Proteínas diferenciales para su Supervivencia frente a Cambios en la salinidad del medio externo y: Al mismo tiempo sub-Expresa Otras Que No hijo Vitales para su Supervivencia. IGUALMENTE, Este estudio permitio determinar S. Que T. consotensis Tiene Proteínas de naturaleza ácida Que probablemente le confieren la s capacidad de tolerar las Condiciones cambiantes de salinidad en su hábitat natural. This flexibility metabólica de T. consotensis es probablemente la causa por la cual sea el Organismo es capaz de CRECER en el Rango de salinidad anteriormente detectado (0 a 40 g · l -1 NaCl) y en las variables de la ONU hábitat conditions estafadores naturales de salinidad. Un análisis Detallado de la identification y Expresion diferencial de Proteínas de T. consotensis en respuesta a las Condiciones de estrés osmótico complementará Nuestro Conocimiento Sobre SUS Mecanismos Moleculares involucrados en la osmoregulación.
agradecimientos
Los Autores agradecen especialmente a Ricardo Acuña y David Rubio de Cenicafé, ya Ivonne Balzer de la Pontificia Universidad Javeriana Por Sus valiosas Orientaciones en el Aprendizaje de las Técnicas de 2-DE. This Investigación se Realizo con el Apoyo Financiero de la Vicerrectoría Académica de la Pontificia Universidad Javeriana, Con permiso de acceso a Recursos Genéticos del Ministerio de Ambiente y Desarrollo Sostenible No. 56 de 2013 y Permiso de Investigación Biológica No. 8, 31 de Octubre de 2006 y Resolución no. 168 (02-04-2009).
CITADA Literatura
Lista de materiales suplementario
Supt. 1. Masa molecular y un punto isoeléctrico de las manchas proteicas Que presentaron Cambios significativos en su Expresion un 0 g · l -1 y 40 g · l -1 de salinidad
Supt. 2. Electroforesis bidimensional de las Proteínas intracelulares extraídas A partir del cultivo de T. consotensis a 5 g · l -1 NaCl. (a) Mapa proteómico Usando tiras IPG pH 3-10NL. (b) Mapa proteómico Usando tiras IPG pH 3-6NL. La primera dimensión se Realizo en tiras IPG (pH 3-10NL y pH 3-6NL, 7 cm). La Segunda dimensión se Realizo Usando El Sistema Mini-Protean Tetra celular con geles de poliacrilamida-SDS al 12%. Tinción con azul de plata . La Concentración de la protein adicionada A Cada gel FUE de 200 g.